ISO13485とは?その重要性やISO9001との違い、要求事項などを網羅的に解説!

ISO13485(品質マネジメントシステム)とは?
世界中のさまざまな標準規格を策定することを目的としている機構のISO(国際標準化機構)ですが、その対象の中には世界的な医療機器の法規制の整合性を高める「ISO13485」があります。 この規格は医療機器を取り扱う企業にとって重要なものであり、以降ではその詳細をご紹介します。
ISO13485の概要
ISO13485は、医療機器の品質マネジメントシステムに関する国際規格であり、医療機器の安全性と品質維持を目的として制定されています。
また、医療機器を取り扱う企業において製品の設計や開発、製造だけではなく、流通から販売、サービスなどのすべてのプロセスに適用されます。
ISO13485が規定された背景
従来の医療機器における法規制は、1970年代に確立されたアメリカの医療機器GMP(Good Manufacturing Practice:製造品質管理基準 )が1つの基準であり、日本でも医療用具GMPを運用していました。
しかし技術が進むにつれ、各国で異なる基準や規格が採用・運用され始め、世界の医療機器法規制の整合化を促進することを目的として「ISO13485」が規定されました。
ISO13485とQMS省令の関係性
日本における医薬品・医療機器に関する法律として「薬機法」がありますが、その薬機法をふまえ、品質管理監督システム(QMS)の組織や文書・運用について定めた基準である「QMS省令」があります。
この省令は、2004年当初の薬機法やISO13485:2003の内容・要件事項が採用されており、基となる制度の変更によって改正されています。
例えば、従来、医薬品・医療機器の製造販売業者はGQP省令の要件を満たす必要がありましたが、平成26年の薬機法の改正によって「QMS省令」の基準を満たす必要があり、一層厳しい要件となりました。また、令和3年3月には2016年に改正されたISO13485:2016の要件に対応したQMS省令の改正が行われており、変更内容について令和6年までの対応が必要となりました。
ISO13485とQMS省令の具体的な違いは、内容と要求されるケースが異なることです。
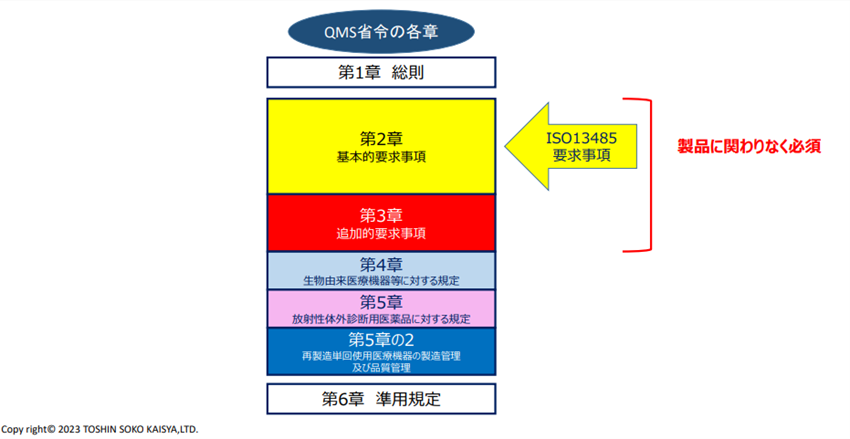
QMS省令は6章構成にて作成されており、2章の基本的要求事項、3章の追加的要求事項については医療機器の製造・販売に関わる日本企業は製品に関わりなく対応することが求められています。一方で、ISO13485の取得は日本国内では、要求されていません。QMS省令の2章の内容はISO13485の国際的な要求事項も反映されており、国内においてはQMS省令を遵守できていれば、ISO13485に基づいた組織・文書・運用ができていると判断されます。
そのため、あくまで日本国内でのみの製造・流通を行うのではあればQMS省令の遵守が必要であり、海外の企業と取引を進める際には、ISO13485の取得を別途行う必要が出てきます。
ISO13485とISO9001の違い
ISO 9001とは、ISO13485のベースとなった規格であり、品質マネジメントシステムにおける国際規格のことです。ISO13485:2016は、ISO9001:2008を基本とした医療機器に特有の要求事項を追加した独立した国際規格です。
規制目的で作成された規格のため、各国の法規制に導入されていますが、ISO9001で求められている「顧客満足度」「継続的改善」は適用されておりません。
どちらも品質マネジメントシステムに関する国際規格ですが、違いとして、ISO9001は、医療機器にとらわれないあらゆる製品に関わる品質マネジメントシステムの国際規格であり、品質向上によって顧客満足度を上げることを目的としています。
対して、ISO13485は、ISO9001では対応しきれない医療機器における安全性の確保や法律の遵守について言及されており、世界中の医療機器法令の整合化が目的とされています。
EU等諸外国の医療機器は「ISO13485」に基づいており、先述した通り、日本のQMS省令も「ISO13485」を基に制定されています。
ISO13485が求める要求事項
ISO13485では、医療機器特有の要求事項として、以下のような項目が規定されています。
- 品質マネジメントシステムにおける目的やプロセス・手順の文書化
- 医療機器ファイルの作成
- 各種リスクマネジメントの実施
- 要員の健康、清潔さ及び衣服
- 製品のトレーサビリティの確保
- 市販後調査および安全管理
- 製品の特性に応じた固有の要求事項
これらはISO13485にて求められている要件であり、日本で定められているQMS省令の第2章部分しか該当しないため注意が必要です。QMS省令3章以降の追加要求事項(文書の保管・記録に関する要件)といった日本独特の事項についても遵守する必要があります。
ISO13485の認証を取得するのは医療機器の品質を担保するのに重要ですが、医療機器物流においても適切な品質管理を行う必要があります。 以下では医療機器物流における品質管理のポイントを5つご紹介していますので、こちらも併せてご覧ください。
医療機器物流における品質管理のポイントとは? よくある問題と解決策をご紹介
ここまで、ISO13485の概要について様々な角度から解説してきました。日本の医療機器を扱う場合はQMS省令の遵守が求められますが、国際的な基準であるISO13485認証を取得することで企業はどのようなメリットを享受できるのでしょうか?
ISO13485認証を取得する3つのメリット
ISO13485を取得するメリットとしては主に以下3つが挙げられます。
メリット①:内部統制の強化
1つ目は、医療機器に関する法令遵守を確実とする体制づくりが求められることで、内部統制が強化されます。
企業はISO13485の要件に従って品質マネジメントシステムを構築することで、医療機器製品の品質向上を開発・製造・販売プロセスを管理・監督する合理的な体制づくりができます。なぜかというと、ISO13485では認証を得る条件として、すべてのプロセスにて以下のようなPDCA(Plan-Do-Check-Action)が必要とされているからです。
- P:顧客要求事項・組織の方針に沿った結果を得るために必要な目標・プロセスを計画(設定)
- D:プロセスの実行
- C:方針・目標・製品要求事項に照らして、プロセス・製品を監視・測定し、結果を報告
- A:プロセスの成果・実施状況を継続的に改善するための処置
ISO13485の認証を取得することで、3年ごとに更新審査を行い、その間の2回はサーベイランス審査があります。ISO13485を維持運営することにより、有効性の維持が期待できます。
ISO13485は法令の遵守や健康、生命の安全性や救済を第一優先とする医療機器のQMSです。安全性を確実に担保すること、医療機器の有効性を効果的に維持することに重きを置いています。
メリット②:顧客からの信頼獲得
2つ目は、顧客からの信頼性が高まり、円滑な取引に繋がります。
ISO13485認証取得は、すなわち品質マネジメントシステムの信頼性を証明するものであり、顧客は認証を取得している企業が医療機器に関する顧客要求事項や法規制への遵守をする体制であると確信できます。また、医療機器を輸出する際に、国・エリアによっては認証取得が必須要件となっている場合もあります。
そのため、顧客からの信頼や安心が生まれ、医療機器業界における競争力強化にも繋がります。
医薬品・医療機器の物流アウトソーシングの市場規模は年々拡大しており、2023年の矢野経済研究所の調査※によると、2021年の市場規模は1170億円となっています。特に昨今は、日本国内に工場を持たない外資系企業による物流のアウトソーシングが進んでおり、医薬品・医療機器の物流サービスを受託する企業にとって、ISO13485認証の取得は選ばれる1つの基準となりえるでしょう。
以下の記事で物流アウトソーシングのメリット・デメリットをご紹介していますので、ぜひご覧ください。
物流アウトソーシングのメリット・デメリットとは?ご検討される方へ
※出所:(株)矢野経済研究所「医薬品・医療器材物流アウトソーシング市場に関する調査(2023年) 」(2023年2月13日発表)
メリット③:調査に関わる費用の削減
先述のように外資系企業による物流のアウトソーシングが進んでいますが、ISO13485を取得していない企業が委託する場合は様々な手間と費用がかかります。
例えば、QMS適合性調査の際には実地調査や書類審査の双方が必要ですが、ISO13485を取得している場合、書類審査のみになるケースが多いです。一般的に実地調査にかかる費用は申請する製造販売業者が負担するため、書類審査のみになった場合、実地調査に関わる費用を節約することができます。 実地調査に関わる費用は、調査員の出張費用も発生するため、企業にとっては出費となります。
調査費用だけでなく、物流コストの削減も重要です。物流コストの削減方法は以下の記事をご覧ください。
物流コストの削減方法とは?コストの内訳や増加する原因も解説
ここまで、ISO13485を取得するメリットについてご紹介してきました。では、ISO13485を取得するためには、どのような手順にて進めればよいのでしょうか。
ISO13485認証を取得する方法
本章では、ISO13485を取得するための基本ステップをご紹介します。
今回は基本のステップを解説しますが、認証を行う機関によって詳細は異なる場合があるため、機関に合わせた対応を行う必要があることを押さえておきましょう。
ステップ①:品質マネジメントシステムの構築
1つ目は、品質マネジメントシステムの構築です。
認証取得に関する情報の取得を行い、経営層が取得を決定します。そのうえで先述したようなISO13485に規定されている要件に対応する組織・文書・運用体制を構築し、必要に応じて現在の業務改善やルール変更を行います。
ステップ②:品質マネジメントシステムの運用
2つ目は、品質マネジメントシステムの運用です。
構築した品質マネジメントシステムにて実際に運用(記録や分析)を行い、内部監査と是正処置を実施します。
ステップ③:登録審査
3つ目は、登録審査(認証取得)であり、認証機関の担当審査監査員によって審査が行われます。
登録審査は合計2回あり、1回目では作成した品質マニュアルや規程がISO13485のルールを満たしているかの書類審査が中心です。そこでは、システムの構築状況などの情報収集が行われます。 その約1か月後、1回目の審査内容を踏まえたうえで、決めたルール通りに作業員が仕事をしているかを確認する実地審査を実施します。
この2つの審査で品質に問題がなく、品質マネジメントシステムが機能していることが確認できたうえでISO13485が取得可能になります。また、先述した通り、ISO13485の取得後は、PDCAを行いながら運用し、3年ごとの更新審査を行い、その間の2回はサーベイランス審査を行います。
医療機器の物流品質担保・円滑な取引を望むのなら、ISO13485の認証を取得した物流会社に依頼すべき
先述したように、ISO13485の認証取得は医療機器を取り扱う企業にとって品質の担保や顧客からの信頼を得るために重要な認証であり、担当者はこの認証に関する知識を深めることが大切です。
特に医療機器の物流に関しては、製品の品質、安全性に大きく影響する為、品質を担保し、医療機器に関する固有の要求事項や法規制への遵守を確実に求めている企業様は、ISO認証を取得した企業へのご依頼がおすすめです。
以下資料では、医療機器物流における品質向上のポイントや、物流を依頼する企業を選ぶ際のポイントをご紹介しています。ご興味のある方はぜひご覧ください。
お役立ち資料

医療機器・化粧品物流における
品質向上のベストプラクティス



